本网讯(通讯员 刘雪文)生命科学蓬勃发展,各种分子互作技术竞相开发并被广泛使用,如pull-down,coip,emsa,酵母双杂等。随着科研发展技术精准化需求的不断提升,这些经典的互作技术都不可避免的存在一定的局限性。2019年7月,生物医药研究院仪器中心配备了一台全新的微量热泳动(mst,microscale thermophoresis)分子互作仪,自启用以来,mst已助力学校科研工作者取得多项科研成果。
2021月8月,我校刘莹团队在acta pharmacologica sinica杂志(医学一区,if 7.169)发表题为《paris saponin vii, a hippo pathwayactivator, induces autophagy and exhibits therapeutic potential against humanbreast cancer cells》的文章。在本研究中,通过mst技术检测发现小分子化合物psvii与hippo通路关键蛋白lats1、mob1、mst2存在相互作用。研究揭示了psvii抑制乳腺癌的分子机制,为乳腺癌的治疗提供了新的治疗靶点及靶向治疗药物用于后续研究。
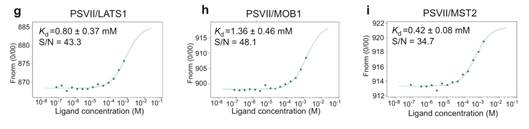 mst技术验证psvii与lats1、mob1、mst2的相互作用(小分子药物与蛋白)
mst技术验证psvii与lats1、mob1、mst2的相互作用(小分子药物与蛋白)
2022年6月,我校李蓓团队在microbiology spectrum杂志(微生物学二区,if9.043)发表一篇题为《high osmotic stress increases ompk36expression through the regulation of kbvr to decrease the antimicrobialresistance of klebsiella pneumoniae》的文章,本课题使用mst技术,通过标记纯化的kbvr蛋白,定量检测其与ompk36和moda启动子区之间结合作用,发现了kbvr能够直接调控ompk36的表达。
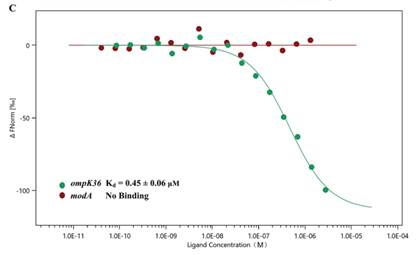
mst技术验证kbvr与ompk36的亲和力(蛋白与核酸)
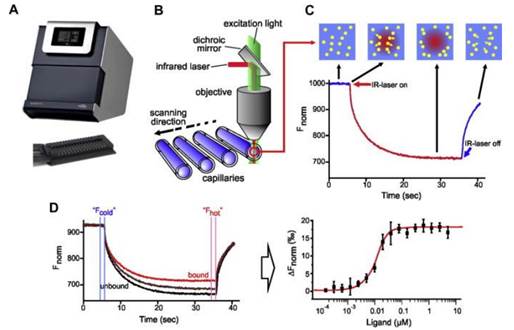
mst技术是通过检测微观梯度场中分子热泳动的变化来分析蛋白-蛋白、蛋白-小分子、蛋白-多肽、蛋白-核酸、蛋白-脂类、蛋白-离子等生物分子间的相互作用,可以在任意缓冲液或生物溶液(细胞裂解液或血清)中进行检测,样品无需固定。该技术的出现弥补了传统技术在样品消耗、缓冲液限制以及操作不便等方面的缺陷因而快速地被应用在各种领域。mst的技术优势为科研争得了有效时间,已成为研究生物分子间相互作用的重要手段。
(编辑 刘莹)